优秀的IVDR上市后监督计划, 怎么能少走这10步?
- 2025-07-23 13:01:31
- 487
1.抓住核心目标
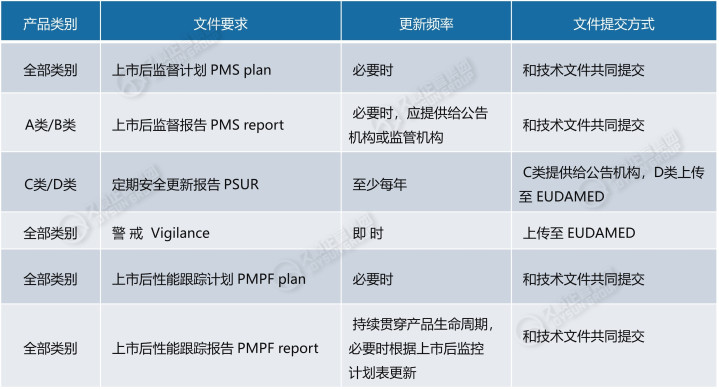
上市后监督PMS文档的主要作用在于:为识别医疗器械收益-风险概况的所有潜在变化,对医疗器械上市后监督数据全面、简洁、关键性的分析。
2.持续更新与同步
上市后监督PMS计划应当被视作动态文件,根据 PSUR/PMS 报告和其他相关报告的需要进行更新。
3.识别和收集源数据
创建报告时需要识别和收集源数据。制造商必须预先充分了解数据并仔细地前期规划,以确保达到一致地检索、编辑和呈现数据。
模板的创建和使用此时对制造商而言受益匪浅,然后核心要义在于:所有模板都必须针对制造商的特有流程和数据源进行定制。
上市后监督数据源的示例(来自ISO/TR 20416附录A):
·客户投诉(包括不良事件报告);
·维护和安装记录;
·上市后临床跟踪PMCF研究;
·退回的医疗器械;
·科学文献;
·公共数据库;
·社会和公共媒体;
·医疗器械的分布和跟踪;
·主管当局的市场监督活动。
4.符合法规列出的数据要求下限
必须确保文档所引用数据至少包括:销售和使用相关数据;产品投诉;严重不良事件报告;现场安全纠正措施;趋势报告;文献研究有关数据;纠正及预防措施CAPA。
5.分析数据
除数据收集外,制造商还应当开展数据分析,以识别可能对医疗器械收益-风险比产生不利影响的趋势或信号,常用分析方法为鱼骨图。
6.定期审查文献
定期审查文献频率应保持至少1季度1次(多多益善),从而确保识别和处理全新的重要安全信息。
此处需特别注意:可能需要审查与医疗器械风险相关的信息,还可能需要总结使用模式相关信息。
7.制定信号和趋势识别处理流程
欧盟体外诊断IVDR法规要求制造商监测趋势和信号,制造商应制定明确适用的流程(涵盖:警限、检测、验证、评估和行动建议等)。
8.遵守法规中所有PMS相关项目
可参阅安全和性能摘要(SSP)和PMPF指南,以掌握MDR和IVDR法规更多解读信息,包括MDCG 2020-7、2020-8中提供的指导。
9.跨职能协调创建信息反馈循环
与跨职能小组协调工作目标在于:生成和批准定期安全更新报告PSUR、上市后监督PMS报告,并创建在PSUR/PMS报告、性能证据报告PER、安全和性能摘要SSP、上市后性能跟踪PMPF之间持续的信息反馈循环。
10.执行文件管理
上市后监督PMS计划和报告属于上市后监督程序的质量记录,应根据制造商质量管理中的文件控制进行管理。PMS计划和报告的审核或批准应由合规负责人(PRRC)负责,文件中应体现器械的Basic UDI-DI。
- 上一篇:高考前一天艺考生被撞病危家属发声
- 下一篇:男子毒杀年幼子女后自杀未遂被刑拘